La partie 11 du titre 21 du Code of Federal Regulations (21 CFR partie 11) définit les critères d’intégrité des données électroniques établis par le Secrétariat américain aux produits alimentaires et pharmaceutiques (FDA). Les entités régies par le FDA, comme les fabricants d’instruments médicaux et les entreprises pharmaceutiques, doivent respecter la réglementation 21 CFR partie 11 pour s’assurer que les dossiers et signatures électroniques sont exacts.
Toutefois, se conformer à ces exigences peut être difficile et prendre beaucoup de temps. Ce blogue présente les difficultés courantes liées au respect de la réglementation 21 CFR partie 11 et donne des façons de les atténuer.
Difficultés liées au respect de la réglementation 21 CFR partie 11
Le respect de la réglementation 21 CFR partie 11 nécessite généralement la création d’instructions de travail visant le respect de chaque règle prescrite, l’élaboration de protocoles de validation pour garantir l’installation, le fonctionnement et les performances appropriés de l’équipement et des logiciels, la création de procédures opérationnelles normalisées (PON), et une formation approfondie du personnel devant utiliser l’équipement et les logiciels.
Tout outil qui facilite ce processus est utile.
De nombreux fabricants œuvrant dans des industries régies par le FDA utilisent notre système d’inspection de la propreté des composants OLYMPUS CIX100. Offrant une interface intuitive, une fonction efficace d’acquisition de données et des options de production rapide de rapports, le système CIX100 peut vous aider à évaluer rapidement et facilement la propreté des composants fabriqués pour déterminer s’ils sont conformes aux normes de l’entreprise et aux normes internationales.
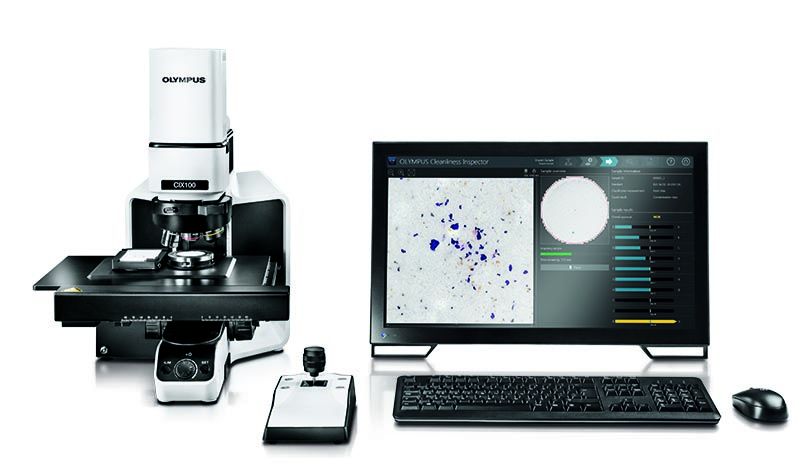
Système d’inspection de la propreté des composants OLYMPUS CIX100
Pour vous aider à respecter les exigences qui vous sont imposées, nous avons créé une « trousse 21 CFR partie 11 » à utiliser avec le système CIX100.
Simplifier le respect de la réglementation 21 CFR partie 11 au moyen du système d’inspection de la propreté des composants CIX100
Notre trousse 21 CFR partie 11 associée au CIX100 montre comment le système CIX100 peut assurer le respect de chaque exigence et fournit des documents liés à l’installation et à l’utilisation du système. Si la trousse est utilisée de façon appropriée, le système CIX100 permettra le respect de la réglementation 21 CFR partie 11.
Contenu de la trousse :
- Documents expliquant comment le système CIX avec Adobe Sign est conforme aux exigences particulières de la réglementation 21 CFR partie 11
- Protocole de validation CIX100 pour la qualification de l’installation et la qualification opérationnelle (IQ/OQ)
- Procédure opérationnelle normalisée (PON) pour le système CIX100 en conformité avec la réglementation 21 CFR partie 11
- Instructions de travail pour la configuration et l’utilisation du système CIX100 en conformité avec la réglementation 21 CFR partie 11
Un guide pour s’assurer du respect de la réglementation 21 CFR partie 11
Grâce à ces ressources détaillées, la trousse vous indique clairement ce que vous devez savoir pour respecter les exigences de la réglementation 21 CFR partie 11. Elle énonce notamment les solutions que nous fournissons, de même que toute responsabilité restante de l’utilisateur. En voici un aperçu :
Voici les solutions d’Olympus pour le respect de la réglementation 21 CFR partie 11 :
- Validation du système pour l’obtention de résultats exacts et fiables au moyen de la qualification de l’installation et la qualification opérationnelle (IQ/OQ)
- Formation sur le CIX100 donnée aux utilisateurs du microscope
- PON détaillée assurant une utilisation appropriée
- Limitation de l’accès au système aux personnes autorisées par la saisie d’identifiants de connexion sur PC sous Windows et par la gestion de droits des utilisateurs
- Utilisation d’Adobe Sign pour fournir des signatures électroniques et faire le suivi des rapports d’inspection d’échantillons en format PDF
Responsabilités de l’utilisateur :
- Fournir de la formation sur Adobe Sign concernant les signatures électroniques et le suivi des données électroniques
- Créer des politiques pour l’utilisation du logiciel CIX100 avec Adobe Sign, pour la surveillance des accès aux précédents rapports d’inspection d’échantillons, et pour le suivi leurs révisions
- Tenir à jour les procédures de gestion des pertes et de conservation des documents
Grâce à cette trousse, le système CIX100 peut vous aider à simplifier vos inspections de la propreté et à respecter ces normes importantes du FDA concernant les dossiers et les signatures électroniques.
Contenu connexe
Introduction à l’inspection de la propreté des composants
Brochure : Understanding International Standards for Technical Cleanliness
Contactez-nous

