連邦規則集(CFR)第21編第11部(21 CFR Part 11)は、米国医薬品局(FDA)が設定した電子データの完全性の基準を規定したものです。 医療機器メーカーや製薬会社など、FDAの規制下にある産業では、21 CFR Part 11に準拠し、正確な電子記録と電子署名を確保しなくてはなりません。
しかし、こうした要件に準拠するのは困難で時間がかかる場合があります。 このブログでは、21 CFR Part 11の準拠に伴う共通の課題を探り、作業を容易にする方法について説明します。
21 CFR Part 11の準拠に伴う課題
通常、規制を遵守するには、個々の21 CFR Part 11規制に適合する作業指示書の作成、機器とソフトウェアの正しい設定、操作、性能を確実にするための検証手順の作成、標準操作手順書(SOP)の作成、機器とソフトウェアを使用するユーザーに対する広範囲のトレーニングが必要です。
このプロセスを簡単にするツールがあれば便利です。
FDAの規制下にある産業の多くの企業は、OLYMPUS CIX100コンタミネーション解析システムを使用しています。 直感的にわかりやすいインターフェース、効率的なデータ収集機能、迅速なレポート作成オプションを備えたCIX100システムは、製造された構成部品の清浄度をすばやく容易に評価して、企業標準や国際規格を遵守しているか判断します。
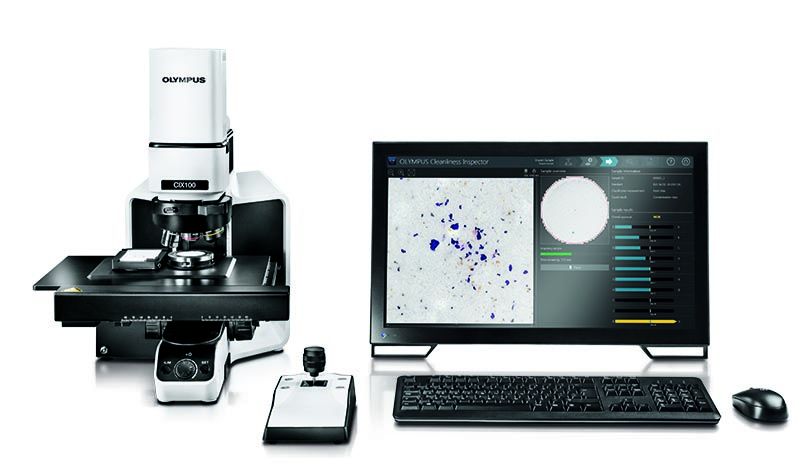
OLYMPUS CIX100コンタミネーション解析システム
これらの要件の準拠を容易にするため、オリンパスはCIX100コンタミネーション解析システム用の21 CFR Part 11パッケージを作成しました。
CIX100コンタミネーション解析システムを使用し容易に21 CFR Part 11準拠
CIX100 21 CFR Part 11パッケージは、CIX100システムで各要件を満たす方法を示し、システム設定および操作用の文書を用意しています。 このパッケージを正しく実行すると、CIX100システムは21 CFR Part 11に準拠します。
パッケージの内容は以下のとおりです。
- Adobe Sign付きのCIX100システムを使い、個別の21 CFR Part 11要件を満たす方法を説明する文書
- 据付時適格性確認/稼働性能適格性確認(IQ/OQ)用のCIX100検証手順
- 21 CFR Part 11に準拠するCIX100システムの標準操作手順書(SOP)
- 21 CFR Part 11に準拠するCIX100システムの設定および操作用作業指示書
21 CFR Part 11準拠への道のり
パッケージでは詳細な資料を使用して、21 CFR Part 11の要件を満たすために必要な知識を明確に示します。 当社が提供しているソリューションと、その他のユーザー責任が含まれます。 以下で概説します。
21 CFR Part 11規則に対するオリンパスのソリューションには、下記が含まれます。
- システムの正確で信頼性のある結果についてIQ/OQを使用した検証
- 顕微鏡ユーザーに対するCIX100トレーニングの提供
- 詳細なSOPを使用した正しい操作の確保
- Windows PCログインとユーザー権限管理による、許可された人へのシステムアクセスの制限
- Adobe Signを使用した、電子署名の提供とサンプル検査のPDFレポートの追跡
ユーザー責任には以下が含まれます。
- 電子署名と電子データ追跡に関するAdobe Signトレーニングの提供
- Adobe Sign付きCIX100ソフトウェアを使用する際のポリシーと、以前のサンプル検査レポートへのアクセスおよび改訂を追跡する際のポリシーの作成
- ロス管理と書類保有の手順維持
このパッケージとともCIX100システムを使用すれば、清浄度検査を合理化し、電子記録と電子署名に関する重要なFDA規制に準拠するのに役立ちます。
関連コンテンツ
OLYMPUS CIX100コンタミネーション解析システムが再現性のある結果を実現する5つの仕組み
お問い合わせ

