Część 11 tytułu 21 Kodeksu Przepisów Federalnych (CFR — Code of Federal Regulations) Stanów Zjednoczonych określa kryteria integralności danych w formie elektronicznej, których spełnienia wymaga Agencja ds. Żywności i Leków (FDA — Food and Drug Administration). Podmioty działające w branżach podlegających nadzorowi FDA, na przykład producenci wyrobów medycznych i firmy farmaceutyczne, muszą spełniać wymagania określone w części 11 tytułu 21 CFR w zakresie rzetelności prowadzenia dokumentacji elektronicznej i stosowania podpisów elektronicznych.
Spełnienie tych wymagań bywa jednak trudne i czasochłonne. W tym artykule na blogu przyjrzymy się typowym wyzwaniom napotykanym na drodze do spełnienia wymagań określonych w części 11 tytułu 21 Kodeksu Przepisów Federalnych oraz omówimy sposoby na to, jak im sprostać.
Wyzwania na drodze do zgodności z częścią 11 tytułu 21 Kodeksu Przepisów Federalnych
Aby zapewnić zgodność z częścią 11 tytułu 21 CFR, podmiot musi zwykle opracować instrukcje postępowania uwzględniające każdy z wymogów wymienionych w tych przepisach, stworzyć protokoły walidacji potwierdzającej prawidłowość konfiguracji, działania i wydajności urządzeń oraz oprogramowania, opracować standardowe procedury operacyjne (SOP) i gruntownie przeszkolić personel z obsługi sprzętu i oprogramowania.
Nic dziwnego, że mile widziane są wszelkie narzędzia ułatwiające ten proces.
Wielu producentów w branżach podlegających nadzorowi FDA używa naszego systemu OLYMPUS CIX100 do kontroli czystości technicznej. Jako rozwiązanie wyposażone w intuicyjny interfejs, efektywne mechanizmy akwizycji danych i funkcje do szybkiego sporządzania raportów, system CIX100 pozwala szybko i łatwo oceniać czystość produkowanych wyrobów w celu zweryfikowania ich zgodności z normami zakładowymi i międzynarodowymi.
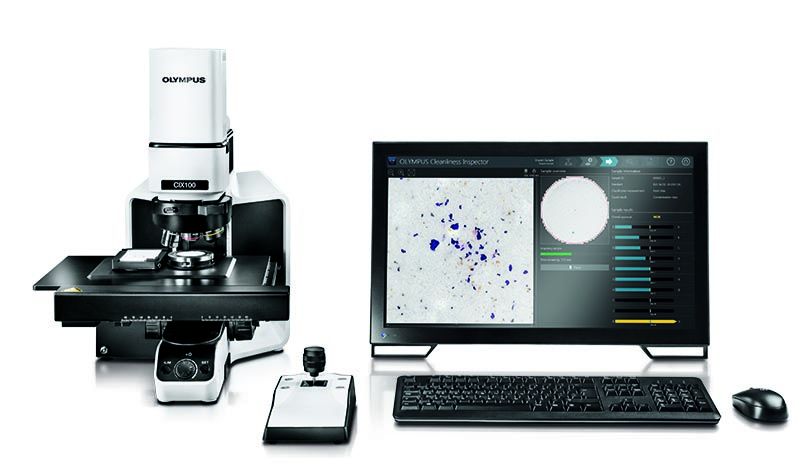
System kontroli czystości OLYMPUS CIX100.
Aby pomóc użytkownikom w spełnieniu wymagań formalnych, opracowaliśmy pakiet zgodności z częścią 11 tytułu 21 CFR dla systemu kontroli czystości CIX100.
System kontroli czystości OLYMPUS CIX100 ułatwia spełnienie wymogów części 11 tytułu 21 CFR
Nasz pakiet zgodności z częścią 11 tytułu 21 CFR zawiera informacje o tym, w jaki sposób system CIX100 może spełnić każde z wymagań, a także obejmuje niezbędną dokumentację konfiguracji i obsługi systemu. Po prawidłowym zaimplementowaniu pakietu system CIX100 będzie spełniał wymagania określone w części 11 tytułu 21 CFR.
Pakiet zawiera:
- dokumenty, w których opisano, w jaki sposób system CIX100 z oprogramowaniem Adobe Sign spełnia szczególne wymagania części 11 tytułu 21 CFR;
- protokół walidacji systemu CIX100 na potrzeby kwalifikacji instalacji/kwalifikacji do działania (IQ/OQ);
- standardową procedurę operacyjną (SOP) dla systemu CIX100 zgodną z częścią 11 tytułu 21 CFR;
- instrukcje robocze konfiguracji i obsługi systemu CIX100 zgodne z częścią 11 tytułu 21 CFR.
Plan osiągnięcia zgodności z częścią 11 tytułu 21 CFR
Wchodzące w skład pakietu szczegółowo opracowane materiały w przejrzysty sposób opisują działania i formalności niezbędne do spełnienia wymogów części 11 tytułu 21 CFR. W szczególności wskazują na rozwiązania, które dostarcza firma Olympus, oraz obowiązki spoczywające na użytkowniku. Oto ich krótki przegląd:
Rozwiązania firmy Olympus służące zgodności z częścią 11 tytułu 21 CFR:
- Walidacja systemu na potrzeby kwalifikacji instalacji/kwalifikacji do działania (IQ/OQ) — w celu zapewnienia dokładności i wiarygodności wyników.
- Szkolenie z obsługi systemu CIX100 dla użytkowników mikroskopów.
- Zapewnienie prawidłowości obsługi poprzez udostępnienie szczegółowej standardowej procedury operacyjnej (SOP).
- Zezwalanie na dostęp do systemu wyłącznie upoważnionym osobom poprzez logowanie na komputerze z systemem Windows i zarządzanie uprawnieniami użytkowników.
- Zastosowanie oprogramowania Adobe Sign do obsługi podpisów elektronicznych i rejestrowania pochodzenia raportów PDF z kontroli próbek.
Obowiązki użytkownika:
- Zapewnienie szkolenia z użycia oprogramowania Adobe Sign do obsługi i śledzenia pochodzenia danych elektronicznych.
- Opracowanie zasad używania oprogramowania CIX100 z oprogramowaniem Adobe Sign oraz rejestrowania dostępów do wcześniejszych raportów z kontroli próbek i modyfikacji tych raportów.
- Utrzymywanie procedur postępowania w razie utraty informacji i przechowywania dokumentów.
System CIX100 z takim pakietem może usprawnić kontrole czystości i ułatwić spełnienie ważnych wymagań FDA w zakresie prowadzenia dokumentacji elektronicznej i stosowania podpisów elektronicznych.
Powiązane treści
Wprowadzenie do kontroli czystości technicznej
5 cech systemu kontroli czystości OLYMPUS CIX100, które zapewniają odtwarzalne wyniki
Broszura: Objaśnienie norm czystości technicznej
Warto nawiązać kontakt

