美国《联邦法规21章》第11款定义了美国食品和药品管理局(FDA)制定的电子数据完整性的标准。受美国食品和药品管理局(FDA)监管的行业,如:医疗设备制造商和制药公司,必须遵守《联邦法规21章》第11款的规定,以确保电子记录和签名的准确性。
然而,要遵守这些要求,既困难又耗时。这篇博客探讨了在满足《联邦法规21章》第11款中要求的过程中所遇到的常见挑战,并讨论了化解这些挑战的方法。
在满足《联邦法规21章》第11款中要求的过程中所遇到的挑战
合规过程通常包括创建工作说明文件,以使工作符合《联邦法规21章》第11款中的每项具体规定;制定验证协议,以确保设备和软件的正确设置、操作和性能;创建标准操作程序(SOP);并对使用设备和软件的人员进行全面的培训。
任何可简化这个过程的工具都有助于我们更好地达到合规目标。
受美国食品和药品管理局(FDA)监管行业中的许多制造商使用我们奥林巴斯的CIX100技术清洁度检测系统。CIX100系统具有界面直观、数据采集高效及报告迅速等优点,有助于用户快速、轻松地评估制造组件的清洁度,以确定它们是否符合公司和国际的标准。
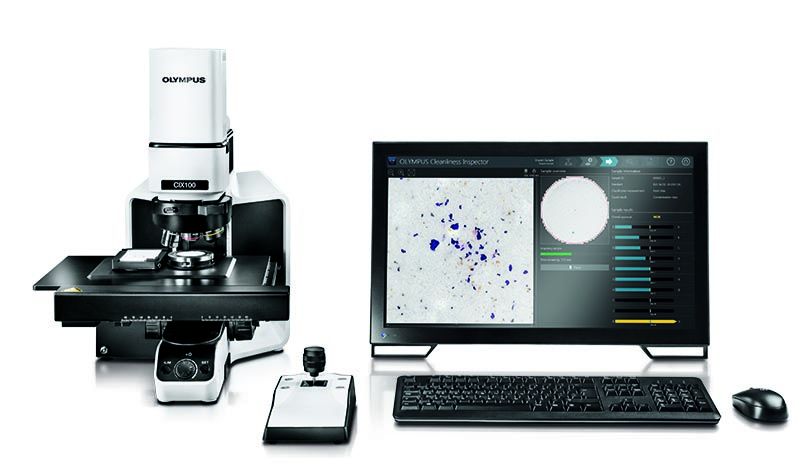
奥林巴斯CIX100清洁度检测系统
为了帮助用户轻松达到合规要求,我们为CIX100清洁度检测系统创建了21 CFR Part 11套装包。
使用CIX100清洁度检测系统简化针对《联邦法规21章》第11款的合规过程
奥林巴斯CIX100清洁度检测系统的21 CFR Part 11套装包展示了CIX100系统如何达到《联邦法规21章》第11款中的每项要求,并提供了有关系统设置和系统操作的文档。如果套装包中的程序被正确实施,CIX100系统的检测就会符合《联邦法规21章》第11款的要求。
套装包中的内容如下:
- 详细说明带有Adobe Sign(Adobe标志)的CIX100系统如何满足《联邦法规21章》第11款中具体要求的文件
- CIX100验证协议,用于安装鉴定/操作鉴定(IQ/OQ)
- CIX100系统符合《联邦法规21章》第11款要求的标准操作程序(SOP)
- CIX100系统有关符合《联邦法规21章》第11款要求的设置和操作的工作说明
确保检测符合《联邦法规21章》第11款要求的引路图
套装包所提供的这些详细的资料,向用户清楚地传达了为满足《联邦法规21章》第11款的要求所需了解的知识。其中包括我们提供的解决方案,以及任何其余的用户责任。下面我们简要概述一下我们的解决方案和用户的责任。
奥林巴斯针对《联邦法规21章》第11款的解决方案:
- 通过安装鉴定/操作鉴定(IQ/OQ)方法验证系统,以获得准确可靠的结果
- 为显微镜用户提供有关CIX100的培训
- 通过详细的标准操作程序(SOP),确保操作准确无误
- 通过Windows PC登录和用户权限管理,只允许获得了授权的个人访问系统
- 使用Adobe Sign功能提供电子签名,并跟踪样品检测的PDF报告
用户责任说明如下:
- 提供有关Adobe Sign的电子签名和电子数据跟踪方面的培训
- 针对带有Adobe Sign的CIX100软件的使用,以及对以前样品检测报告的访问和修订的跟踪而制定政策
- 维持有关损失管理和文件保留的程序
CIX100系统的这个套装包不仅有助于简化清洁度检测过程,而且还有助于达到美国食品与药物管理局(FDA)有关电子记录和签名的重要标准。
相关内容
奥林巴斯CIX100清洁度检测系统提供可再现性结果的5种方式
联系我们

